Giáo án tự chọn Hóa 11 giành cho giáo viên THPT tham khảo. Kính mong các thầy cô giáo và các bạn đọc giả tham khảo và ủng hộ bài viết của trang nhé.!
Giáo án tự chọn Hóa 11
Xem thêm bài viết trước:
|
Ngày Soạn:……………………….. Ngày dạy:………………………… Tiết 1: ÔN TẬP I. Mục tiêu: Rèn luyện kĩ năng giải bài tập về nguyên tử, cân bằng phản ứng oxi hoá khử, tính phần trăm khối lượng. II. Nội dung lên lớp Bài 1: Nguyên tử của nguyên tố X có tổng số hạt p, n và e bằng 40, tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12. Xác định Z, A và viết cấu hình e của nguyên tố X, cho biết vị trí nguyên tố X trong BTH Giải: Ta có: p + n + e = 40 Mà p = e = Z 2p + n = 40 (1); Theo bài rat ta có 2p – n = 12 (2) Từ (1) và (2) ta có: p = Z =13, n = 14; A = Z + n = 13 + 14 = 27 Cấu hình electron của nguyên tố X là: 1s22s22p63s23p1 Ô thứ 13; Chu kì 3; Nhóm chính nhóm IIIA Bài 2: Cân bằng các phương trình sau bằng phương pháp cân bằng pứ oxi hoá khử. Al + HNO3 Al(NO3)3 + NO + H2O Fe + H2SO4 (đ) Fe2(SO4)3 + SO2 + H2O Giải:
Al + HNO3 Al(NO3)3 + NO + H2O
1x Al Al + 3e
1x N + 3e N Al + 4HNO3 Al(NO3)3 + NO + 2H2O
Fe + H2SO4 (đ) Fe2(SO4)3 + SO2 + H2O
3 Fe Fe + 3e
2 S + 2e S 2Fe + 6H2SO4 (đ) Fe2(SO4)3 +3SO2 + 6H2O Bài 3: Cho 1,5g hỗn hợp gồm Al và Mg vào dd HCl1M người ta thu được 1,68 lít khí ở ( đktc) a/ Tính % khối lượng mỗi kim loại. b/ Thể tích axit đã dung. Giải: 2Al + 6HCl 2AlCl3 + 3H2 x 3x 3/2x Mg + 2HCl MgCl2 + H2 y 2y y Gọi x, y lần lượt là số mol của Al, Mg 27x + 24y = 1,5 x = 1/30 3/2x + y = 0,075 y = 0,025 % Mg = ; % Al = 60 % ; Củng cố – dặn dò – Cân bằng phương trình sau đây bằng phương pháp cân bằng phản ứng oxi hoá khử. Al + HNO3 Al(NO3)3 + N2 + H2O FexOy + HNO3 Fe(NO3)3 + NO + H2O BTVN: Hoà tan hoàn toàn 1,12 g kim loại hoá trị II vào dd HCl thu được 0,448 lít khí ở đktc. X/đ kim loại hóa trị II.
Ngày Soạn:……………………….. Ngày dạy:………………………… Tiết 2: BÀI TẬP SỰ ĐIỆN LI – AXIT, BAZƠ VÀ MUỐI I. Mục tiêu: Viết phương trình điện li, phân biệt được chất điện li mạnh, yếu; giải thích được tính axit, bazơ, theo thuyết Arêniut, hiđroxit lưỡng tính. II.Tiến trình lên lớp: Bài 1: Viết phương trình điện li của các chất trong dd sau: HBrO4, CuSO4, Ba(NO3)2, HClO, HCN. Cho biết chất nào là chất điện li mạnh, chất nào là chất điện li yếu. Giải: HBrO4 H+ + BrO4– CuSO4 Cu2+ + SO Ba(NO3)2 Ba2+ + 2NO HClO H+ + ClO– HCN H+ + CN– HBrO4, CuSO4, Ba(NO3)2 là chất điện li mạnh. HClO, HCN là chất điện li yếu. Bài 2: Viết phương trình điện li của hiđroxit lưỡng tính Al(OH)3. Giải: Al(OH)3 Al3+ + 3OH– Al(OH)3 H3O+ + AlO Bài 3: Viết phương trình phản ứng xảy ra khi cho Al2(SO4)3 tác dụng với NaOH dư. Giải:
Al2(SO4)3 + 6NaOH 2Al(OH)3 + 3Na2SO4 Al(OH)3 + NaOH NaAlO2 + 2H2O Bài 4: Dựa vào thuyết Arêniut. Giải thích NH3 là một bazơ. Giải: NH3 + H2O NH + OH– Bài 5: Trong một dd có chứa a mol Ca2+, b mol Mg2+, c mol Cl–, d mol NO. a/ Lập biểu thức liên hệ a, b, c, d. b/ Nếu a = 0,01; c = 0,01; d = 0,03 thì b bằng bao nhiêu. Giải: a/ Trong một dd, tổng điện tích của các cation bằng tổng điện tích của các anion, vì vậy: 2a + 2b = c + d b/ b = Củng cố – Theo thuyết Arêniut, chất nào dưới đây là axit? A. Cr(NO3)3 B. HBrO3 C. CdSO4 D. CsOH – Theo thuyết Arêniut, chất nào dưới đây là bazơ? A. Cr(NO3)3 B. HBrO3 C. CdSO4 D. NH3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tải xuống – Giáo án tự chọn Hóa 11
Link tải: download
Hướng dẫn tải về:
Đầu tiên bạn click vào link tải: download , sau đó tài liệu hiện ra ở một tab mới.
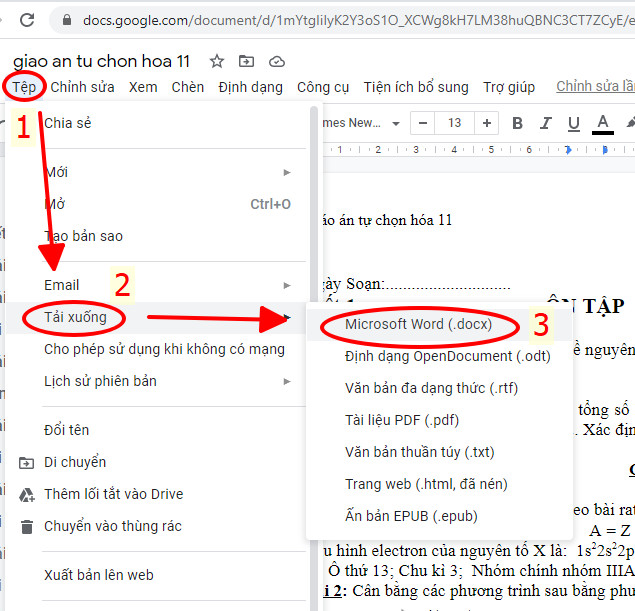
Bước 1: Bạn di chuột tới phần: Tệp
Bước 2: Bạn di chuột tới phần Tải xuống.
Bước 3: Bạn click vào Microsoft word (.docx) để tải tập tin về máy

Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa 11
Thẻ: Giáo án tự chọn Hóa 11, Giáo án tự chọn Hóa học 11, Giáo án tự chọn môn Hóa 11, giáo án môn hóa học 11
Xem thêm tài liệu tham khảo:
Chuyên đề nhận biết và phân biệt các chất
Ma có thật hay chỉ là hiện tượng hóa học