Điều chế chất khí trong phòng thí nghiệm và một số lưu ý khi thực hiện một số thí nghiệm quan trọng như điều chế các khí quen thuộc như: Oxi, Cacbon đioxit, amoniac, etilen, …. và một số lưu ý cần quan tâm. Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
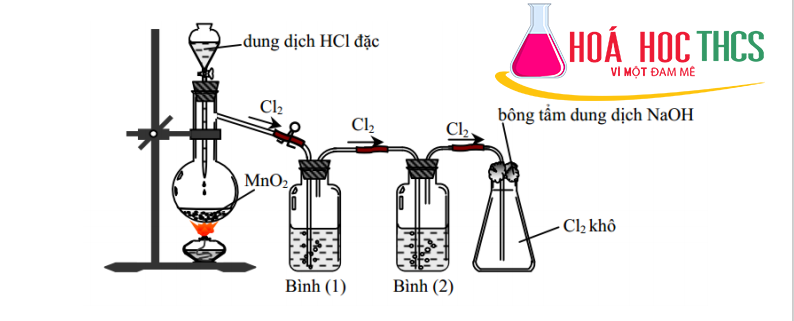
1. Điều chế một số chất khí trong phòng thí nghiệm:
a. Chất lỏng tác dụng với chất rắn:
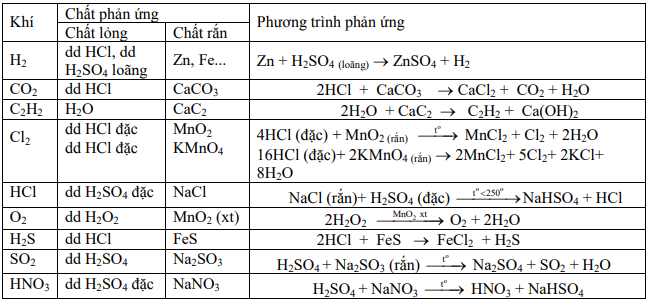
b. Chất lỏng tác dụng với chất lỏng:
 2. Một số lưu ý khi điều chế
2. Một số lưu ý khi điều chế
a. Đối với khí etilen
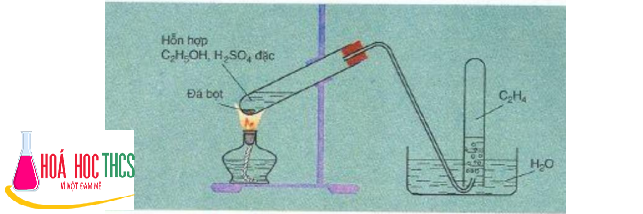
- Khí etilen sinh ra có lẫn CO2 và SO2. Để khí không lẫn tạp chất thì cần phải dẫn qua bông tẩm NaOH đặc để loại bỏ 2 khí này.
- Phản ứng xảy ra ở 170°C nên phải cho đá bọt vào để hỗn hợp không sôi đột ngột và quá mạnh sẽ trào chất lỏng ra ngoài, không đảm bảo an toàn khi làm thí nghiệm.
b. Đối với khí oxi

- Nếu điều chế oxi bằng nhiệt phân chất rắn thì lắp ống nghiệm sao cho miệng ống nghiệm hơi chúc xuống để đề phòng hỗn hợp có chất rắn ẩm, khi đun hơi nước không chảy ngược lại làm vỡ ống nghiệm.
- Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun.
- KClO3 là chất dễ gây nổ nên không nghiền nhiều một lúc và không nghiền lẫn với bất kì chất nào khác. Lọ đựng KClO3 không để hở nút cạnh: P, C, S nút lọ đựng KClO3 không độn giấy vào
- Từ: KMnO4 điều chế oxi tuy ít hơn từ KClO3 nhưng dễ mua không cần dùng chất xúc tác và ít gây nguy hiểm.
- Khi thu khí O2, đề kiểm tra O2 đã đầy bình chưa ta đưa tàn đóm đỏ vào miệng bình thấy bùng cháy chứng tỏ O2 đã đầy bình
c. Đối với Amoniac:
Điều chế khí amoniac trong phòng thí nghiệm

- Làm khô khí bằng CaO. Để điều chế một lượng nhỏ NH3 thì đun nóng dung dịch NH3 đậm đặc
d. Đối với Metan:

- Thu metan bằng phương pháp đẩy nước do metan không tan trong nước.
- Phải dùng CaO mới, không dùng CaO đã rã, CH3COONa phải thật khan trước khi làm thí nghiệm. Nếu hỗn hợp phản ứng bị ẩm thì phản ứng xảy ra chậm.
- Phải đun nóng bình cầu khí metan mới thoát ra không để ngọn lửa lại gần miệng ống thoát khí.
- Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun.
- Khi tháo rời thiết bị nên làm trong tủ hút và tắt hết lửa xung quanh
- Sử dụng glixerol để bôi trơn bề mặt tiếp xúc giữa thủy tinh và cao su
Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
3. Cách thu khí.
Phải nắm vững tính chất vật lý (tính tan và tỉ khối) để áp dụng phương pháp thu khí đúng.
a. Phương pháp đẩy không khí:
- Khí không phản ứng với oxi của không khí.
- Nặng hơn hoặc nhẹ hơn không khí (CO2, SO2, Cl2, H2, NH3…). Úp ống thu khí với khí nhẹ hơn không khí và ngửa ống thu khí với khí nặng hơn không khí.
b. Phương pháp đẩy nước:
- Khí ít tan trong nước. (H2, O2, CO2, N2, CH4, C2H4, C2H2…).
- Các khí tan nhiều trong nước (khí HCl, khí NH3):
- Ở 20oC, 1 thể tích nước hòa tan tới gần 500 thể tich khi hiđro clorua.
- Ở điều kiện thường, 1 lít nước hòa tan khoảng 800 lít khí amoniac.
Lưu ý: SO2 là khí tan nhiều trong nước chứ không giống như CO2 đâu.
Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
4. Làm khô khí
Nguyên tắc chọn chất làm khô.
Giữ được nước và không có phản ứng với chất cần làm khô.
- Các chất làm khô: H2SO4 đặc, P2O5, CaO (vôi sống, mới nung), CuSO4 (khan, màu trắng), CaCl2 (khan), NaOH, KOH (rắn hoặc dung dịch đậm đặc).
- Các khí: H2, Cl2, HCl, HBr, HI, O2, SO2, H2S, N2, NH3, CO2 , C2H4, C2H2…
- Không làm khô được khí NH3 (tính bazơ),
- Không làm khô được khí HBr, HI (tính khử).
- H2SO4 đặc làm khô được khí Cl2, O2, SO2, N2, CO2…
- CaO (vôi sống), NaOH, KOH (rắn) (tính bazơ):
- Không làm khô được khí CO2, SO2 (oxit axit), Cl2 (có phản ứng).
- Làm khô được khí NH3, H2, O2, N2…
Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
5. Tách và tinh chế các chất
a. Nguyên tắc chung:
- Các chất ở trạng thái khác nhau (lỏng – rắn, lỏng – khí, rắn – khí) thì tách được ra khỏi nhau.
- Các chất lòng không tan vào nhau thì tách được ra khỏi nhau.
- Các chất rắn có kích thước khác nhau thì tách được ra khỏi nhau.
- Các chất có khối lượng riêng khác nhau thì tách được ra khỏi nhau.
Ngoài ra còn dựa vào sự khác nhau về tính chất vật lí (có từ tính, thăng hoa, khả năng hấp thụ. hấp phụ, …). tính chất hóa học để tách chất.
Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
b. Các phương pháp điển hình
- Phương pháp chưng cất: Cơ sở của phương pháp chưng cất: Dựa vào nhiệt độ sôi khác nhau của các chất lỏng trong hỗn hợp. Nội dung phương pháp chưng cất: Khi đun sôi một hỗn hợp lỏng, chất nào có nhiệt độ sôi thấp hơn sẽ chuyển thành hơi sớm hơn và nhiều hơn. Khi gặp lạnh, hơi sẽ ngưng tụ thành dạng lỏng chứa chủ yếu là chất có nhiệt độ sôi thấp hơn.
- Phương pháp kết tinh: Cơ sở của phương pháp kết tinh: Dựa vào độ tan khác nhau của các chất rắn theo nhiệt độ. Nội dung của phương pháp kết tinh: Hòa tan chất rắn vào dung môi đến bão hòa, lọc tạp chất rồi cô cạn, chất rắn trong dung dịch sẽ kết tinh ra kliòi dung dịch theo nhiệt độ (chất tách ra có thể ngậm nước)
- Phương pháp lọc: Cơ sờ của phương pháp lọc: Dùng để tách các chất không tan ra khỏi hỗn hợp lỏng
Thí dụ: Đường bị lẫn một ít cát. Để làm sạch đường bằng phương pháp vật lí ta hòa tan hỗn hợp đường và cát vào nước. Khi đó đường bị tan vào nước còn lại cát không tan. Cho giấy lọc vào phễu, lọc và thu phần nước lọc, đem cô cạn phần nước lọc ta thu được đường.
- Phương pháp chiết: Cơ sở của phương pháp chiết: Dựa vào độ tan khác nhau trong nước hoặc trong dung môi khác của các chất lỏng, chất rắn. Khi hai chất lỏng không trộn lẫn được vào nhau chất lỏng nào có khối lượng riêng nhỏ hơn sẽ tách thành lớp trên, chất lỏng nào có khối lượng riêng lớn hơn sẽ nằm ở phía dưới. Nội dung của phương pháp chiết: Dùng dụng cụ chiết (phễu chiết) tách các chất lòng không hòa tan vào nhau ra khỏi nhau (chiết lỏng – lỏng). Người ta còn thường dùng chất lỏng hoà tan chất hữu cơ để tách chúng ra khỏi hồn hợp rắn (chiết lỏng – rắn).
- Phương pháp lắng gạn: Cơ sở của phương pháp lắng gạn: Dùng để tách các chất rắn có khối lượng liêng khác nhau ra khỏi nước hoặc đung dịch.
Ví dụ: Bột CuO bị lẫn bột than. Để tách riêng bột CuO ra khỏi hồn hợp bằng phương pháp vật lí ta cho hỗn hợp trên vào cốc, thêm nước vào, khấy đều rồi lắng gạn. Làm đi làm lại nlũều lần, bột than nhẹ sẽ trôi theo nước ra ngoài, bột CuO chìm xuống đáy. Lúc này ta thu được CuO bằng phương pháp lọc.
- Phương pháp từ tính: Cơ sở của phương pháp từ tính: Dùng để tách chất bị nhiễm từ (bị nam châm hút) ra khỏi hỗn hợp rắn gồm chát bị nhiễm từ và chất không bị nhiễm từ (Một số chất bị nhiễm từ là Fe.Fe3O4,…).
Thí dụ: Để tách riêng Fe và Cu ra khỏi hỗn hợp bằng phương pháp vật lí ta dùng thanh nam châm (đã bọc nilon mỏng), chà nhiều lần lên hỗn hợp. Do sắt có tính nhiễm từ nên bị hút vào thanh nam châm, còn đồng thì không bị hút do không có tính nhiễm từ. Làm đi làm lại nhiều lần ta thu được sắt riêng, đồng riêng.
Ngoài các phương pháp trên còn nhiều phương pháp khác như: phương pháp điện di, thẩm thấu, săc ký, li tâm, hấp phụ, thăng hoa,…
Điều chế chất khí trong phòng thí nghiệm và một số lưu ý
Các bài viết khác:
Đề thi HSG môn hóa học 8 huyện Hậu Lộc – Thanh Hóa
Kế hoạch bài dạy môn hóa THPT module 3
Đáp án tự luận môn KHTN modun 3
Thẻ: Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý, Điều chế chất khí trong phòng thí nghiệm và một số lưu ý hay nhất.
Liên hệ: Facebook: Sinhh Quách
Fanpage: TrangHoahocthcs