Hãy thiết lập biểu thức tính số mol chất theo số nguyên tử hoặc số phân tử của chất
C. Hoạt động luyện tập
1. Em hãy bổ sung thông tin vào các ô trống trong bảng sau đây theo mẫu:
| Nguyên tử | Nguyên tử khối (đvC) | Khối lượng mol nguyên tử (gam/mol) | Chất | Phân tử khối (đvC) | Khối lượng mol phân tử (gam/mol) |
| O | 16 | 16 | Khí oxi: O2 | 32 | 32 |
| H | 1 | Natri clorua: NaCl | 58,5 | ||
| Cl | Khí clo: Cl2 | ||||
| Na | 23 | ||||
| Ca | 40 | Canxi cacbonat: CaCO3 | |||
| K | 39 | Kali clorua: KCl |
2. Hãy thiết lập biểu thức tính số mol chất theo:
a, Số nguyên tử hoặc số phân tử của chất
b, khối lượng chất
c, Thể tích ( đối với chất khí)
3. Thảo luận và bổ sung thông tin vào các ô trống trong bảng theo mẫu dưới đây:
| Mẫu chất | số mol | Khối lượng | Thể tích (lít, đktc) |
| 16 gam khí Oxi | 0,5 | – | |
| 4,48l khí Oxi (đktc) | – | ||
| 6,022.1022 phân tử khí Oxi | |||
| 6 gam Cacbon | – | ||
| 0,4 mol khí Nito | – | ||
| 9ml nước lỏng | 9 gam | – |
4. Khí Z là hợp chất của nito và oxi, có tỉ khối so với H2 bằng 22
a, Tính khối lượng mol phân tử của khí Z
b, Lập công thức phân tử của khí Z
c, Tính tỉ khối của khí Z so với không khí (Mkk= 29 gam/mol)
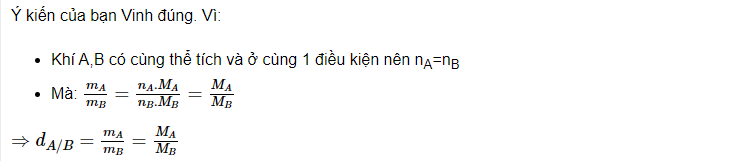
5. Thảo luận về tình huống sau: Bạn Vinh cho rằng có thể tính tỉ khối của khí A so với khí B theo công thức dA/B=mA/mB trong đó mA,mB là khối lượng của V lít khí A,B tương ứng ở cùng điều kiện. Ý kiến của bạn Vinh đúng hay sai ? Giải thích.
6. Tiến hành các thí nghiệm như sau: Đặt vào 2 đĩa cân đang ở trạng thái cân bằng các bình khí Oxi và khí Cacbonic như hình 6.1

a, Kim đồng hồ của cân sẽ lệch về phía nào? Giải thích.
b, Nếu không làm thí nghiệm có thể dự đoán/biết được kim cân sẽ lệch về phía nào không? Giải thích.
7. Nếu giả sử không khí gồm khí nito (80% thể tích) và oxi (20% thể tích) thì khối lượng của 22,4 lít không khí ở (đktc) bằng bao nhiêu?
a, Hãy so sánh với thông tin ở hình 6.2 và giải thích.
b, Nếu coi không khí là một khí thì khối lượng mol phân tử không khí bằng bao nhiêu.

8. Khi điều chế không khí trong phòng thí nghiệm, một bạn học sinh đã thu khí băng cách như trong hình 6.3. Bạn học sinh đó làm đúng hay sai ? Em hãy giải thích.

Trả lời:
| Nguyên tử | Nguyên tử khối (đvC) | Khối lượng mol nguyên tử (gam/mol) | Chất | Phân tử khối (đvC) | Khối lượng mol phân tử (gam/mol) |
| O | 16 | 16 | Khí oxi: O2 | 32 | 32 |
| H | 1 | 1 | Natri clorua: NaCl | 58,5 | 58,5 |
| Cl | 35,5 | 35,5 | Khí clo: Cl2 | 71 | 71 |
| Na | 23 | 23 | |||
| Ca | 40 | 40 | Canxi cacbonat: CaCO3 | 100 | 100 |
| K | 39 | 39 | Kali clorua: KCl | 74,5 | 74,5 |
2.
a, số mol = số nguyên tử hoặc phân tử của chất : số A-vô-ga-đro (6,022.1023)
b, số mol = khối lượng chất : Khối lượng mol của chất
c,

3.
| Mẫu chất | số mol | Khối lượng | Thể tích (lít, đktc) |
| 16 gam khí Oxi | 0,5 | – | 11,2 |
| 4,48l khí Oxi (đktc) | 0,2 | 6,4 gam | – |
|
6,022.1022 phân tử khí Oxi |
0,1 | 3,2 gam | 2,24 |
| 6 gam Cacbon | 0,5 | – | 11,2 |
| 0,4 mol khí Nito | – | 11,2 gam | 8,96 |
| 9ml nước lỏng | 0,5 | 9 gam | – |
4.

5.
6.

7.
Vì không khí ở đktc nên: nkk = 22,4 : 22,4 = 1 (mol)
Vì Nito chiếm 80% thể tích không khí: nN2=1.0,8=0,8 (mol)
VÌ Oxi chiếm 20% thể tích không khí: nO2=1.0,2=0,2 (mol)
Khối lượng của không khí là: mkk=mCO2+mO2 = 0,8 . 28 + 0,2 . 32 = 28, 8 (gam)
b, Nếu coi không khí là một khí thì khối lượng mol phân tử không khí bằng 29 (gam/mol)
8.
Bạn học sinh đó làm đúng. Vì: khí Cacbonic nặng hơn không khí ( 44 > 29 )nên khi thu khí bằng phương pháp bình ngửa sẽ đẩy không khí ra ngoài vì thế trong bình chỉ còn khí Cacbonic
Tìm kiếm google: Giải sách giáo khoa KHTN 7 | Giải bài tập KHTN 7 | Giải bài tập sách KHTN 7; Giải KHTN 7 Bài 6. Mol, tỉ khối của chất khí; Hãy thiết lập biểu thức tính số mol chất theo số nguyên tử hoặc số phân tử của chất

Các bài viết khác:
Giải sách giáo khoa KHTN 6 Kết nối tri thức
Giáo Án PPT KHTN lớp 6 Sách Kết Nối Tri Thức
Giáo Án PPT KHTN lớp 6 Sách Chân Trời Sáng Tạo
Liên hệ: Facebook: Sinhh Quách
Fanpage: PageHoahocthcs
♥Cảm ơn bạn đã xem: Giải sách giáo khoa KHTN 7 | Giải bài tập KHTN 7 | Giải bài tập sách KHTN 7; Hãy thiết lập biểu thức tính số mol chất theo số nguyên tử hoặc số phân tử của chất; Hãy thiết lập biểu thức tính số mol chất theo số nguyên tử hoặc số phân tử của chất