Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014 giành cho giáo viên giảng dạy bộ môn hóa học tham khảo, và các bạn khối lớp 12 ôn luyện. Mời quý thầy cô giáo và các bạn cùng tham khảo nhé. Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014
Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014
Đề thi:
| UBND TỈNH THÁI NGUYÊN
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
KÌ THI CHỌN HỌC SINH GIỎI TỈNH LỚP 12 NĂM HỌC 2013-2014
MÔN THI: HOÁ HỌC (VÒNG 1) (Thời gian làm bài 180 phút không kể thời gian giao đề) |
Câu 1: (3,0 điểm)
- Có 6 lọ hóa chất bị mất nhãn, mỗi lọ đựng một dung dịch muối nitrat của một kim loại: Ba(NO3)2, Al(NO3)3, Pb(NO3)2, Zn(NO3)2, AgNO3, Cd(NO3)2. Chỉ được dùng 3 hóa chất làm thuốc thử, hãy nhận biết từng dung dịch muối. Trình bày cách tiến hành thí nghiệm để nhận biết mỗi dung dịch muối đựng trong mỗi lọ và viết phương trình hóa học xảy ra (dạng phương trình ion).
- Cho sơ đồ các phương trình hóa học:
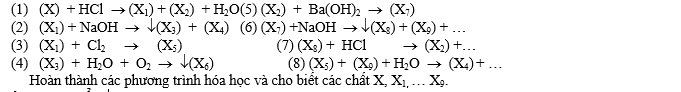
Câu 2: (4,0 điểm)
1. Cho 3 nguyên tố A, R, X (ZA<ZR<ZX) đều ở nhóm A và không cùng chu kì trong bảng tuần hoàn. Tổng số lượng tử chính của electron cuối cùng của 3 nguyên tử A, R, X (kí hiệu lần lượt là: nA, nR, nX) bằng 6; tổng số lượng tử phụ của chúng bằng 2; tổng số lượng tử từ bằng -2 và tổng số lượng tử spin bằng –1/2 trong đó số lượng tử spin của eA là +1/2.
a. Xác định A, R, X. Cho biết dạng hình học của phân tử A2R và A2X. So sánh góc hóa trị trong 2 phân tử đó và giải thích.
b. Đối với phân tử A2XR3 và ion XR42-, hãy viết công thức kiểu Lewis, cho biết dạng hình học và trạng thái lai hóa của nguyên tử trung tâm.
2. Hợp chất vô cơ X thành phần có 2 nguyên tố, có 120 < MX < 145. Cho X phản ứng với O2 thu được chất duy nhất Y. Cho Y phản ứng với H2O thu được 2 axit vô cơ A và B. A phản ứng với dung dịch AgNO3 thu được kết tủa trắng C, kết tủa này tan trong dung dịch NH3. B phản ứng với dung dịch NaOH dư thu được muối D. D phản ứng với dung dịch AgNO3 thu được kết tủa vàng E. Chất X khi phản ứng với H2O thu được 2 axit là G và A, khi đun nóng G thu được axit B và khí H.
Xác định công thức phân tử các chất A, B, C, D, X, Y, G, H và viết các phương trình hóa học xảy ra.
Câu 3: (3,0 điểm)
- Hiđrocacbon A có CTPT là C9H10. A có khả năng tác dụng với Br2 khan, xúc tác bột Fe, t0. Cho A tác dụng với H2, xúc tác Ni, t0 thu được B có CTPT là C9H12. Oxi hoá B bằng O2 trong H2SO4 thu được axeton. Xác định CTCT và gọi tên A, B. Viết các PTHH xảy ra. Trình bày cơ chế phản ứng khi B tác dụng với Br2 khan, xúc tác bột Fe, t0.
- Viết các PTHH thực hiện dãy chuyển hóa sau:
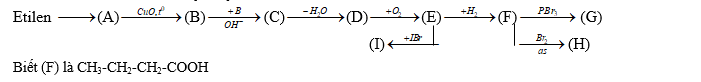
Câu 4 : ( 5,0 điểm )
1. a. Tính pH của dung dịch A gồm KCN 0,120M; NH4Cl 0,150M và KOH 0,155M.
b. Tính thể tích dung dịch HCl 0,210M cần cho vào 50,00 ml dung dịch A để pH của hỗn hợp thu được bằng 9,24.
Cho biết Ka của HCN là 10-9,35; của là 10-9,24.
2. Cho 37,2 gam hỗn hợp X gồm : R, FeO, CuO (R là kim loại chỉ có hóa trị II, hidroxit của R không có tính lưỡng tính) vào 500 gam dung dịch HCl 14,6 % (HCl dùng dư), sau phản ứng thu được dung dịch A, chất rắn B nặng 9,6 gam (chỉ chứa một kim loại) và 6,72 lít H2 (đktc). Cho dung dịch A tác dụng với dung dịch KOH dư, thu được kết tủa D. Nung kết tủa D trong không khí đến khối lượng không đổi thu được 34 gam chất rắn E gồm hai oxit.a.
a. Tìm R và % khối lượng của mỗi chất trong hỗn hợp X .
b. Tính nồng độ phần trăm của các chất trong dung dịch A.
Câu 5: ( 5,0 điểm )
1. Hỗn hợp X gồm hai chất A,B là đồng phân của nhau chứa C,H,O, mỗi chất chỉ chứa một nhóm chức, đều có phản ứng với NaOH theo tỉ lệ mol là 1:1. Lấy 12,9 gam hỗn hợp X cho tác dụng vừa đủ với 75 ml dung dịch NaOH 2M thu được hỗn hợp Y.
a. Xác định công thức phân tử của A,B.
b. Chia hỗn hợp Y thành 2 phần bằng nhau. Một phần cho tác dụng hết với dung dịch AgNO3 trong NH3 dư thu được 21,6 gam kết tủa Ag. Một phần đem cô cạn thu được 6,55 gam hỗn hợp muối khan. Xác định công thức cấu tạo phù hợp của A,B và tính khối lượng mỗi chất trong 12,9 gam hỗn hợp X.
2. Thủy phân không hoàn toàn peptit A, có phân tử khối là 293 đvC và chứa 14,3% N (theo khối lượng) thu được 2 peptit B và C. Mẫu chứa 0,472 gam peptit B khi đun nóng, phản ứng hoàn toàn với 18 ml dung dịch HCl 0,222 M. Mẫu chứa 0,666 gam peptit C khi đun nóng, phản ứng hoàn toàn với 14,7 ml dung dịch NaOH 1,6% (khối lượng riêng của dung dịch NaOH là 1,022 g/ml). Xác định CTCT của peptit A.
(Cho: H=1; C =12; N=14; O=16; Na=23; Be=9; Mg=24; Al=27; P=31; S=32; Cl=35,5; K=39; Fe=56; Cu=64; Br=80; Ag=108.)
……………….Hết…………………
( Giám thị coi thi không giải thích gì thêm)
Hướng dẫn chấm:
| UBND TỈNH THÁI NGUYÊN
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
KÌ THI CHỌN HỌC SINH GIỎI TỈNH LỚP 12 NĂM HỌC 2013-2014
MÔN THI: HOÁ HỌC (VÒNG 1 ) (Thời gian làm bài 180 phút không kể thời gian giao đề)
HƯỚNG DẪN CHẤM |
Câu 1: ( 3,0điểm )
- Có 6 lọ hóa chất bị mất nhãn, mỗi lọ đựng một dung dịch muối nitrat của một kim loại: Ba(NO3)2, Al(NO3)3, Pb(NO3)2, Zn(NO3)2, AgNO3, Cd(NO3)2. Chỉ được dùng 3 hóa chất làm thuốc thử, hãy nhận biết từng dung dịch muối. Trình bày cách tiến hành thí nghiệm để nhận biết mỗi dung dịch muối đựng trong mỗi lọ và viết phương trình hóa học xảy ra (dạng phương trình ion).
Hướng dẫn chấm:(1,5 điểm)
Dùng dung dịch axit clohiđric, dung dịch natri hiđroxit, dung dịch amoniac làm thuốc thử.
Tiến hành thí nghiệm để nhận biết mỗi dung dịch muối:
Đánh số thứ tự cho mỗi lọ hóa chất bị mất nhãn.
Thí nghiệm 1: Mỗi dung dịch muối được dùng ống hút nhỏ giọt (công tơ hút) riêng biệt để lấy ra một lượng nhỏ (khoảng 3 ml) dung dịch vào mỗi ống nghiệm đã được đánh số tương ứng. Dùng công tơ hút lấy dung dịch HCl rồi nhỏ vào mỗi dung dịch muối trong ống nghiệm, có hai dung dịch xuất hiện kết tủa, đó là các dung dịch Pb(NO3)2, AgNO3 do tạo thành các kết tủa trắng PbCl2 và AgCl.
Thí nghiệm 2: Tách bỏ phần dung dịch, lấy các kết tủa PbCl2, AgCl rồi dùng công tơ hút nhỏ dung dịch NH3 vào mỗi kết tủa, kết tủa nào tan thì đó là AgCl, do tạo ra [Ag(NH3)2]Cl, còn kết tủa PbCl2 không tan trong dung dịch NH3. Suy ra lọ (5) đựng dung dịch AgNO3, lọ (3) đựng dung dịch Pb(NO3)2. Các phương trình hóa học xảy ra:
| Pb2+ + 2 Cl– → PbCl2↓
Ag+ + Cl– → AgCl↓ AgCl + 2 NH3 → [Ag(NH3)2]Cl |
(1)
(2) (3) |
Còn lại 4 dung dịch Al(NO3)3, Ba(NO3)2, Zn(NO3)2, Cd(NO3)2 không có phản ứng với dung dịch HCl (chấp nhận bỏ qua các quá trình tạo phức cloro của Cd2+). Nhận biết mỗi dung dịch muối này:
Thí nghiệm 3: Cách làm tương tự như thí nghiệm 1 nhưng thay dung dịch HCl bằng dung dịch NaOH. Nhỏ từ từ NaOH cho đến dư vào mỗi dung dịch muối trong ống nghiệm, dung dịch Ba(NO3)2 không có phản ứng với dung dịch NaOH, còn ba dung dịch Al(NO3)3, Zn(NO3)2 và Cd(NO3)2 tác dụng với NaOH đều sinh ra các kết tủa trắng, nhưng sau đó kết tủa Cd(OH)2 không tan, còn Al(OH)3 và Zn(OH)2 tan trong NaOH dư. Nhận ra được lọ (1) đựng dung dịch Ba(NO3)2; lọ (6) đựng dung dịch Cd(NO3)2. Các phương trình hóa học xảy ra:
| Al3+ + 3 OH– → Al(OH)3↓
Al(OH)3 + OH– → [Al(OH)4]– Zn2+ + 2 OH– → Zn(OH)2↓ Zn(OH)2 + 2 OH– → [Zn(OH)4]2– Cd2+ + 2 OH– → Cd(OH)2↓ |
(4)
(5) (6) (7) (8) |
Còn lại 2 dung dịch Al(NO3)3, Zn(NO3)2. Nhận biết mỗi dung dịch muối này:
Thí nghiệm 4: Cách làm tương tự như thí nghiệm 1 nhưng thay dung dịch HCl bằng dung dịch NH3. Nhỏ từ từ dung dịch NH3 cho đến dư vào từng dung dịch Al(NO3)3, Zn(NO3)2 đựng trong 2 ống nghiệm, dung dịch muối nào tạo ra kết tủa không tan là dung dịch Al(NO3)3 (2), còn dung dịch nào tạo thành kết tủa, sau đó kết tủa tan thì đó là dung dịch Zn(NO3)2 (4).
Các phương trình hóa học xảy ra:
| Al3+ + 3 NH3 + 3H2O → Al(OH)3↓ + 3 NH4+
Zn2+ + 2 NH3 + 2H2O → Zn(OH)2↓ + 2 NH4+ Zn(OH)2 + 4 NH3 → [Zn(NH3)4]2+ + 2 OH– |
(9)
(10) (11) |
.
.
.
Còn tiếp…. Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên
Tải xuống
Để xem tài liệu đầy đủ và chi tiết hơn, mời các bạn Click vào ô TẢI VỀ
Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên : TẢI VỀ
Các bài viết tham khảo thêm:
Đề thi HSG môn Hóa học lớp 12 Tỉnh Thanh Hóa 2015-2016
Tại sao Hàn the là một chất gây hại cho sức khỏe nhưng lại được sử dụng trong thực phẩm?
Liên hệ: Facebook: Sinhh Quách
Fanpage: PageHoahocthcs
♥Cảm ơn bạn đã xem: Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014, Đề thi HSG môn Hóa học lớp 12 Tỉnh Thái nguyên 2013-2014,